Internacional
Comienzan Pfizer y BioNTech estudio de su vacuna contra Covid-19 en embarazadas
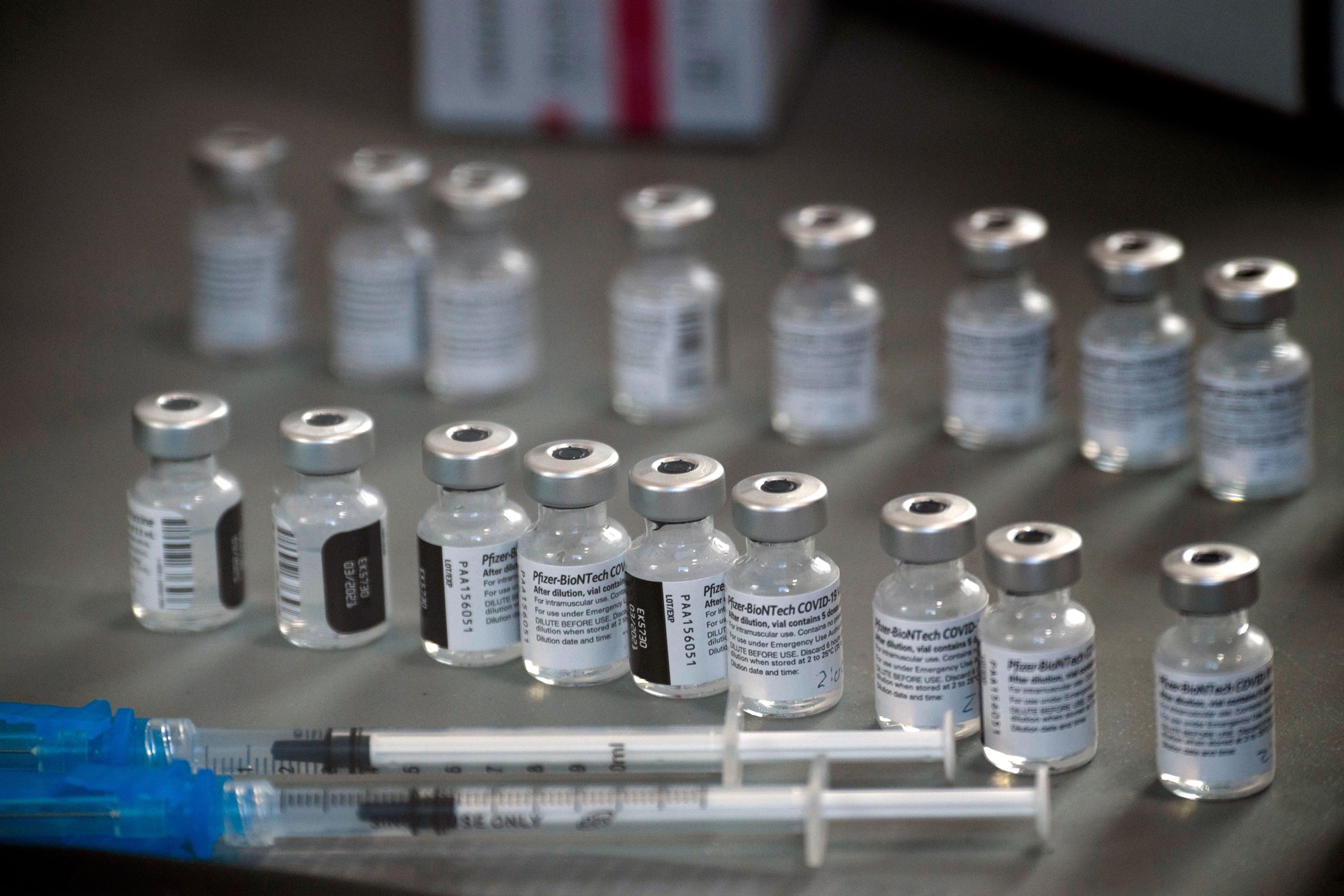
Las farmacéuticas Pfizer y BioNTech anunciaron el inicio de un estudio de forma global para evaluar a fondo la seguridad, tolerabilidad y eficacia de su vacuna contra el Covid-19 en mujeres embarazadas sanas de 18 años en adelante, con el fin de tener un amplio acceso a la vacuna, ya que este sector de la población corre mayor riesgo de contraer la enfermedad.
A través de un comunicado, las compañías indicaron que el ensayo global de fase 2/3 está diseñado como un estudio aleatorio que será controlado con placebo en aproximadamente 4 mil mujeres embarazadas sanas de 18 años o mayores, que estén vacunadas durante la semana 24 a la 34 de su gestación, mientras que se evaluará la seguridad de dos dosis de la BNT162b2 y placebo, las cuales serán administradas con una diferencia de 21 días.
Asimismo, cada mujer participará en este ensayo en un tiempo de 7 a 10 meses, así como se revisará la seguridad en los bebés de las mujeres embarazadas que hayan recibido la vacuna y supervisar la transferencia de anticuerpos potencialmente protectores a sus bebés.
«Estamos orgullosos de comenzar este estudio en mujeres embarazadas y continuamos recopilando evidencia sobre seguridad y eficacia para respaldar potencialmente el uso de la vacuna en subpoblaciones importantes. Las mujeres embarazadas tienen un mayor riesgo de complicaciones y de desarrollar COVID-19 grave, por lo que es fundamental que desarrollemos una vacuna que sea segura y eficaz para esta población», dijo el vicepresidente de investigación y desarrollo clínicos de vacunas de Pfizer, William Gruber.
De acuerdo con Pfizer, antes de realizar este ensayo clínico, se llevaron a cabo estudios de toxicidad para el desarrollo y la reproducción con la sustancia BNT162b2, el cual fue requerido por las autoridades reguladoras antes de comenzar con este estudio en mujeres embarazadas.
Te puede interesar: Admite Rusia no tener capacidad para satisfacer demanda de su Sputnik V
Por otro lado, las farmacéuticas prevén comenzar con estudios adicionales de sus vacunas en niños de entre 5 y 11 años en los siguientes meses, en tanto, la seguridad y eficacia en menores de 12 a 15 años ya se está evaluando, por lo que los datos relevantes podrían ser presentados ante las autoridades reguladoras durante el segundo trimestre del 2021.
-

 Nación1 día ago
Nación1 día agoAnuncia Sheinbaum a Carlos Augusto Morales como su secretario particular
-

 Nación1 día ago
Nación1 día agoSheinbaum ratifica a Zoé Robledo como titular del IMSS
-

 Nación1 día ago
Nación1 día agoCuestiona AMLO a Anabel Hernández por “culpar al Ejército sin pruebas del caso Ayotzinapa
-

 Nación2 días ago
Nación2 días agoTEPJF perfila avalar elección presidencial; comisión declara infundada la pretensión de nulidad pedida por el PRIAN



























